 Lisez cet article en version anglaise
Lisez cet article en version anglaise- Share this article
- Abonnez-vous à notre newsletter
Utiliser des « ciseaux génétiques » pour éliminer spécifiquement certains types de cellules
L’utilisation de ciseaux moléculaires permet de modifier l’ADN – porteur de l’information génétique – des végétaux. À ce jour, la méthode CRISPR/Cas, co-élaborée pour les végétaux par le professeur Holger Puchta, biologiste moléculaire à l’Institut botanique du l’Institut de technologie de Karlsruhe (KIT), a déjà été utilisée
pour introduire, échanger ou combiner spécifiquement des gènes. L’objectif est d’améliorer la résistance de la plante aux maladies et aux impacts environnementaux. Le système CRISPR (acronyme de Clustered Regularly Interspaced Short Palindromic Repeats)/Cas revient à utiliser des ciseaux moléculaires spécifiquement capables de reconnaître et de couper des séquences ADN.
« Il y a 30 ans que nous étudions l’utilisation de ciseaux moléculaires dans le domaine végétal. Au début, nous les utilisions pour modifier des gènes individuellement. Il y a deux ans, nous avons été les premiers au monde à restructurer des chromosomes complets, » déclare Holger Puchta. Pour cette étude, le pionnier de l’édition génomique a reçu deux fois la célèbre subvention avancée du Conseil européen de la recherche (CER). « Nous avons réussi à optimiser cette méthode. Avec CRISPR-Kill, nous avons atteint un niveau de développement entièrement nouveau : nous pouvons éliminer certains types de cellules végétales et empêcher la formation de certains organes végétaux. »
Les résultats de l’étude ont été présentés dans Nature Communication, en mars 2022.
Éliminer les racines secondaires et les pétales avec CRISPR-Kill
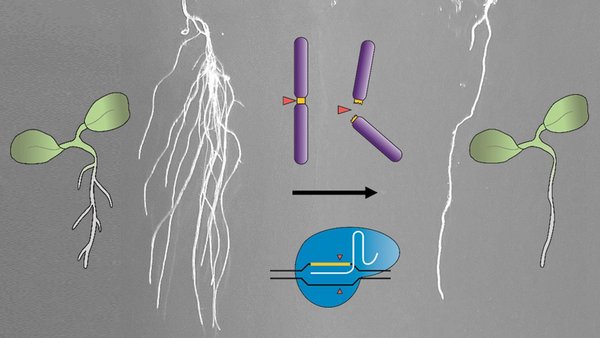
Les expériences réalisées par les chercheurs visaient plus particulièrement les racines secondaires et les pétales de la plante modèle, à savoir un cresson sauvage (Arabidopsis thaliana) appelé Arabette de Thalius. « Ces expériences sont classiques en biologie. Dans ce cas précis, nous connaissons le programme génétique et les types de cellules qui sont importants pour la formation de ces organes végétaux, » explique le biologiste moléculaire. Une fois ces cellules éliminées, les végétaux CRISPR-Kill n’ont plus formé de pétales et de racines secondaires, alors que les plantes témoins ont poussé normalement.
Contrairement à d’autres méthodes d’élimination de cellules au moyen de cytotoxines ou de rayonnement laser, CRISPR-Kill effectue de multiples coupes dans le génome. Un génome comprend un certain nombre de chromosomes sur lesquels les gènes individuels sont disposés dans un ordre fixe.
« Jusqu’à présent, CRISPR/Cas visait précisément un endroit et faisait une coupe ou deux pour modifier un gène ou un chromosome, » déclare Holger Puchta. « Nous avons reprogrammé nos ciseaux moléculaires. Ils ne se contentent plus d’intervenir une fois sur l’ADN génomique ; ils visent, dans le type de cellule concerné, une séquence souvent rencontrée dans le génome et essentielle pour la survie de la plante. Ainsi, plusieurs coupes sont effectuées en même temps – bien trop pour que la cellule puisse les réparer. La cellule est condamnée à mourir. »
Mieux comprendre les processus de développement des plantes
On peut considérer que les travaux des chercheurs du KIT entrent dans le cadre de la recherche fondamentale. « En étudiant ce qui se passe lorsqu’un certain type de cellule est éliminé, nous en apprenons plus sur les processus de développement des végétaux. Comment la plante réagit-elle ? De quelle souplesse la plante fait-elle preuve pendant son développement ? Par exemple, est-il possible d’éliminer des parties de la plante qui ne sont pas nécessaires en agriculture ? », ajoute Holger Puchta.
À long terme, la production alimentaire et les applications pharmaceutiques pourraient profiter de cette technologie, par exemple lorsqu’on empêche la plante de produire des cellules qui produisent des toxines. La technologie pourrait en outre être utilisée dans des organismes multicellulaires pour la modification spécifique de tissus.
Publication originale
Angelina Schindele, FabienneGehrke, Carla Schmidt, Sarah Röhrig, Annika Dorn, &HolgerPuchta: Using CRISPR-Kill for organ specific cell elimination by cleavage of tandem repeats. Nature Communications, mars 2022. DOI: 10.1038/s41467-022-29130-w.
Pour en savoir plus :
Lien avec le site web du KITE




Ajoutez un commentaire
Soyez le premier à faire un commentaire